Д-р Елмира Павлова дм
Малигненият меланом (ММ) остава една от най - интересните загадки в съвременната медицина, а контролът на това заболяване е истинско предизвикалество. Усилията на много поколения изследователи и клиницисти са довели до подобряване на прогнозата при пациентите с начални, тънки меланоми. Днес 5-годишната и 10-годишната преживяемост след хирургична ексцизия на меланоми I стадий достигат съответно 97% и 93% (1). Печалната слава на “малкия черен тумор” продължава да се свързва с напредналите случаи на болестта (стадии IIIb, IIIc, IV). Болните с далечни метастази (стадий IV) преживяват по-малко от 12 месеца (2). В последно време се наблюдава значителен напредък във възможностите за системна терапия на пациенти с това заболяване. Две стратегии за лечение, базирани на имунотерапията и геномиката, сега предлагат реална надежда за подобряване качеството на живот и удължаване на преживяемостта , макар и със сериозен риск от странични ефекти и високи разходи за лекарства. Прицелната терапия с vemurafenib, мощен селективен инхибитор на BRAF митациите, както и имунотерапията с ipilimumab, анти-CTLA-4 антитяло, постигат революция в контрола на меланомната болест и дават надежда на пациентите с напреднало заболяване. С въвеждането на четирите нови медикамента (ipilimumab, vemurafenib, dabrafenib и trametinib) при дисеминирани меланоми през последните 3 години е постигнато повече, отколкото през предишните 2 - 3 десетилетия.
1. ВЪВЕДЕНИЕ
1.1. Определение
Малигненият меланом (ММ) произхожда от меланоцитите в кожата, които претърпяват малигнена трансформация. Рядко възниква в окото (увеята, конюнктивата и цилиарното тяло), менингите и различни мукозни повърхности. ММ има висок метастатичен потенциал и това обуславя неблагоприятната му прогноза (3).
1.2. Епидемиология
Честотата на ММК се увеличава през последните декади сред всички бели популации в света. Заболяемостта в Европа се колебае от 3-5/100000 души в Средиземноморските страни до 12-20 /100000 в Северните части на континента. В САЩ показателят варира около 20-30 на 100 000, а в Австралия достига 50-60/100000 сред белите популации (3,4).
Тъй като част от пациентите с първичен меланом се лекуват амбулаторно и не се регистрират , вероятната заболеваоност у нас е по- висока. В България през 2010 г заболяемостта е 6,3 на 100000 мъже и 6,2 на 100000 жени. Показателите са сходни с тези в южноевропейските стани. От новооткритите случаи 24% са в III стадий, а 10,2% в четвърти (23). За година у нас се регистрират 479 нови случая ва ММ , а броя на починалите от това заболяване е около 157 души годишно.
По-голям риск за развитие на ММК имат лицата с атипични меланоцитни невуси (АМН), с множество обикновини меланоцитни невуси (ОМН), с големи, конгенитални невуси. Наследствеността при меланома в повечето случаи е полигененна; 5-10% от меланомите се появяват във фамилии, предразположени към заболяването. Освен конституционалните и генетичните особености, най-важният екзогенен фактор са ултра-виолетовите лъчи (УВЛ). С особено висок риск е свързано интензивното интермитентно слънчево въздействие при хора със светлла кожа, кожни фототипове I и II (3).
1.3. Клинични форми на ММ
Суперфициалният ММ е повърхностно разпространяващ се меланом, който започва с вътрешно - епидермална хоризонтална или радиална фаза на растеж първо като макула, която бавно се развива в плака, често с множество цветове и бледи зони на регресия. Може да се развият и вторични нодуларни зони в макулата.
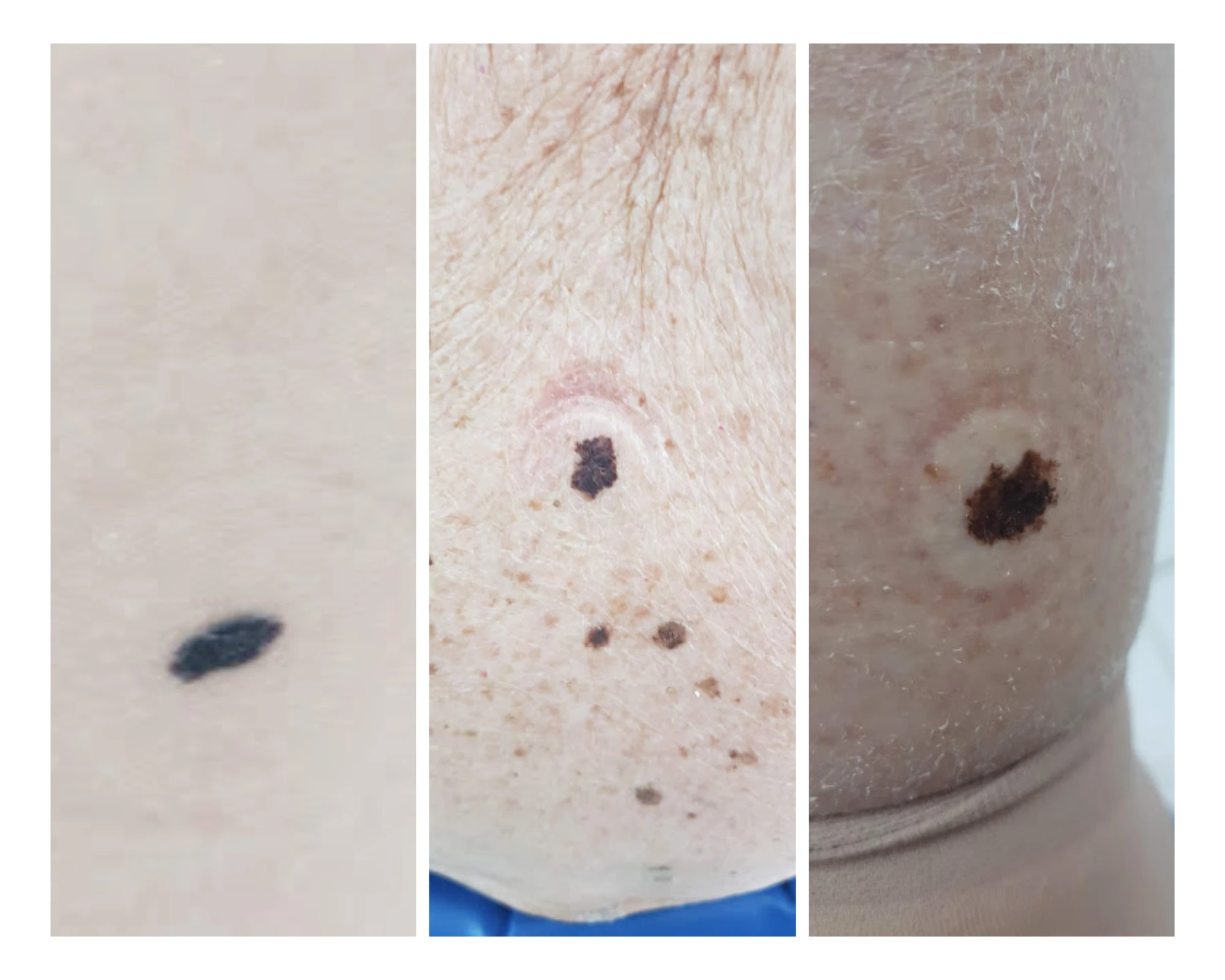
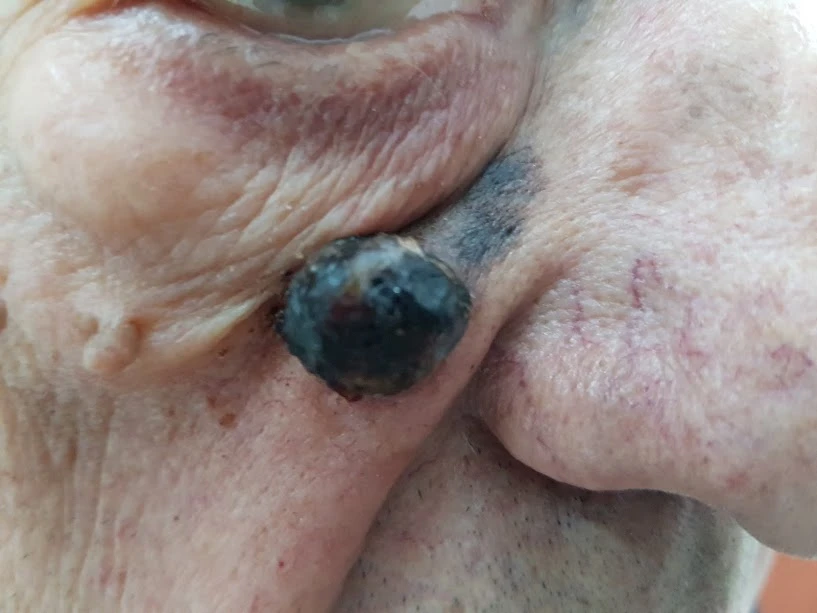
Нодуларният меланом е с екзофитен растеж,кафяво - черен, често ерозирана възловидна лезия, която прокървява и се характеризира с агресивна вертикална фаза, с кратка или липсваща хоризонтална фаза на растеж. По този начин, ранно идентифициране в интраепидермален стадий е почти невъзможно.
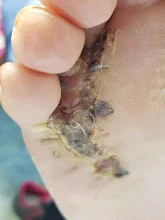
Lentigo maligna melanoma възниква често след много години от меланом in situ (меланом на място ) разположен предимно върху увредени от слънцето лица на по-възрастни пациенти. тоза. Акралните меланоми обикновено са с палмоплантантарна локализация или под ноктите.
Освен това има няколко редки варианта на меланома, като дезмопластичен, амеланотичен и полипоиден меланоми, които съставляват по-малко от 5% от случаите. Има и т.нар. НПО меланоми, при които първичният тумор не може да бъде открит, а само метастатичните ЛВ. Последните молекулярни изследвания са показали генетичната хетерогенност на меланома. Тези скорошни постижения откриват възможността за ново генериране на класификации на меланома, който ще вземе предвид не само епидемиологията и патология, но и профилите на мутация и вероятно други биологични биомаркери. ММК, свързани с интермитентна инсолация са разположени главно върху трункуса и крайниците и често носят BRAF-мутация. ММК, асоциирани с хронично излагане на слънце се локализират предимно в областта на главата и шията и имат умерена честота на NRAS-мутации. ММК, които възникват на кожата в акралните области на тялото и върху лигавиците показват ниска честота на с-KIT-мутации и нямат връзка със слънчевото експониране (3, 7, 8).
1.5. Прогноза и стадиране
Около 90% от меланомите се диагностицират като първични тумори без доказателства за метастази. При новрхностните меланоми 10-годишната преживяемост за такива тумори е 75 до 85%. Най-важната хистологична прогноза за първичен меланом без метастази като отразени в последните проучвания, са както следва вертикалната дебелина на тумора (дълбочината на Breslow), измерена на - хистологичен образец с оптична микрометрова скала и определена като хистологична дълбочина на тумора от гранулозния слой на епидермиса до най-дълбоката точка на инвазия. Наличие на улцерации хистологично в тумора.Разязвязваето на меланома се определя като комбинация от следното характеристики: дебелината н амеланома (включително отсъствие на роговия слой и базалната мембрана), отлагането на фибрин, неутрофили и - изтъняване на епидермиса. Митотичният индекс (брой митози / mm 2 ) се явява като независим прогностичен фактор при няколко проучвания се използва за подкласификация на тънките меланоми през 2009 г. (AJCC класификация). Прогнозата е по - лоша при увеличаване на възрастта, мъжете, прпи локализации на ММ на главата и шията в сравнение с меланоми по крайниците.
2. Адювантна и таргетна терапия
2.1. Адювантна терапия
Адювантната терапия е допълнителна терапия, приложена след първично лечение на меланома, обикновено след хирургична ексцизия. Целта на адювантната терапия е да се намали рискът от рецидив на меланома.
Лекарите често препоръчват адювантната терапия при пациенти с меланом при ангажиране на лимфни възли или пациенти с метастатично заболяване, които са претърпели пълна хирургична резекция. Високорисковият меланом обикновено се определя като меланом, който е по-дълбок или по-дебел (с дебелина повече от 4 мм) или включва ангажирането на близките лимфни възли. Тези пациенти имат висок риск от рецидив, тъй като някои меланомни клетки могат да останат в тялото, дори ако хирургичната ексцизия е успешна и е премахнат видимият меланомен тумор.
Пациентите обикновено получават адювантна терапия след първично лечение с хирургична интервенция. Адювантната терапия може да намали риска от повторна поява на меланома. Американската администрация по храните и лекарствата (FDA) одобри три лекарства като адювантна терапия за високорисков меланом:
- Интерферон (интрон и силатрон)
- Ипилимумаб (Yervoy)
- Nivolumab (Opdivo)
- Dabrafenib + трамениб (Tafinlar + Mekinist)
Откритието на BRAF мутаиите даде тласък в развитието на нов клас лекарства т.нар. таргетна терапия. Приблизително 50% от всички меланоми имат мутация в гена, който кодира произведството на протеин, наречен BRAF.В първа линия на лечение новата таргетна терапия показва обещаващи резултати.
2.2. Таргетна терапия
Тези медикаменти атакуват части от меланомните клетки, които ги правят различни от нормалните. Целевите лекарства работят по различен начин от стандартните лекарства за химиотерапия , които основно атакуват всякакви бързо делящи се туморни клетки. Понякога целенасочените лекарства работят, когато химиотерапията не действа. Те могат да имат и по - малко тежки странични ефекти. Лекарите все още усвояват най-добрия начин да използват тези медикаменти за лечение на меланома. Около половината от всички меланоми имат промени (мутации) в BRAF гена. Меланомните клетки с тези промени променят протеин BRAF, който им помага да растат. Някои лекарства са насочени към това и свързаните с него протеини, като протеините МЕК. Ако имате меланом, може да се тества биопсична проба от него, за да се види дали раковите клетки имат BRAF мутация. Лекарствата, които са насочени към протеина BRAF (BRAF инхибитори) или MEK протеините (MEK инхибитори), няма вероятност да работят при хора, чиито меланоми имат нормален BRAF ген. През 2012 година в ЕС и у нас беше разрешен за употреба лекарственият продукт Zelboraf (вемурафениб ). Този препарат е показан като монотерапия за лечение на пациенти с положителна за BRAF мутация неоперабилен или метастазирал меланом. Zelboraf е перорален инхибитор на BRAF киназата, с ниско молекулно тегло. Мутациите в BRAF гена, при който се замества валина на аминнокиселинна позиция 600, водят до конституитивно активиране на BRAF протеините, което може да причини клетъчна пролиферация при отсъствие на растежни фактори, необходими за този процес. Най-често, ако човек има BRAF мутация и се нуждае от таргетна терапия, той ще получи както инхибитор на BRAF, така и инхибитор на МЕК, тъй като комбинирането на тези медикаменти често работи по-добре в комбинация, отколкото монотерапия.
BRAF инхибитори
Вемурафениб (Zelboraf), дабрафениб (Tafinlar) и ендорафениб (Braftovi) са медикаменти, които директно атакуват BRAF протеина.
Тези лекарства забавят растежа на туморите при някои хора, чийто метастазирал меланом има промяна в гена за BRAF . Те също могат да помогнат на някои пациенти да живеят по - дълго, въпреки че меланомът обикновено метастазира.
Дабрафениб може да се използва(заедно с трамениб след хирургична ексцизия при хора с меланом III стадий , където може да помогне за намаляване на риска от персистенция и рецидив на рака. Честите нежелани реакции могат да включват ксероза и десквамация на кожата, екзантеми, пруритус, фотосензитивност, главоболие, треска, болки в ставите, умора, косопад и гадене. По - редките, но сериозни нежелани реакции могат да включват проблеми със сърдечния ритъм, проблеми с черния дроб,увеличени трансаминази, бъбречна недостатъчност, тежки алергични реакции, тежки проблеми с кожата или очите, кървене и повишени нива на кръвната захар.
Някои хора, лекувани с тези медикаменти, развиват други кожни немеланомни карцином.Необходимо е вашият дерматолог или дерматоонколог да проследява пациентите на таргетна терапия за кожни неоплазии.
MEK инхибитори
Генът MEK работи заедно с BRAF гена, така че лекарствата, които блокират MEK протеините, също могат да помогнат при лечението на меланоми с промени в BRAF гена. Инхибиторите на МЕК включват трамениб (Мекинист), кобиметиниб (Котеленц) и биниметиниб (Mektovi) . Честите нежелани реакции могат да включват кожен екзантем, гадене, диария, отоци и повишена фоточувствителност. Редки, но сериозни нежелани реакции могат да включват: аритмии или увреждане на черния дроб, кървене или тромбемболии, мускулни увреждания и кожни инфекции.
Кобиметиниб в комбинация с вемурафениб е нов одобрен МЕК инхибитор за първа линия на лечение с пациенти с метастатичен меланом с мутации на BRAF V600. Той подобрява честотата на туморния отговор и преживяемостта без прогресия в сравнение с вемурафениб самостоятелно, като същевременно намалява токсичността поради парадоксалното активиране на MAPK сигналния път.
Отново, най-честият подход е да се комбинира инхибитор на МЕК с BRAF инхибитор. Това изглежда свива туморите за по-дълъг период от време, отколкото при използването на двата вида медикаменти самостоятелно. Някои нежелани реакции (като развитие на други видове рак на кожата) всъщност са по-рядко срещани при комбинацията.
Лекарства, насочени към клетки с C-KIT генни промени
Малка част от меланомите имат промени в гена C-KIT , който им помага да се развиват. Тези промени са по-чести при меланомите, които са с локализация:
- На дланите на ръцете, стъпалата на краката или под ноктите (известни като акрални меланоми)
- Вътре в устна кухина или други мукози
Някои целеви лекарства, като иматиниб (Gleevec) и нилотиниб (Tasigna) , могат да засегнат клетките с промени в C-KIT. Ако имате меланом, който е започнал в посочената анатомична област, вашият лекар може да тества вашите меланомни клетки за промени в гена C-KIT, което може да означава, че едно от тези лекарства може да бъде полезно.
Pembrolizumab (Keytruda) е лекарство за имунотерапия, което спомага за свиване на туморите и помага на пациентите с напреднал меланом да живеят по-дълго. Пембролизумаб е анти-PD-1 инхибитор, който е:
- Вид имунотерапия, известна като инхибитор на контролно-пропускателен пункт, която помага на раковите клетки да са по-уязвими към атакуването от имунната система на тялото ви
- Антитяло, което подпомага тумор-убиващите ефекти на Т-клетките (белите кръвни клетки, които помагат на организма ви да се бори с болестта)
- Пембролизумаб блокира активността на молекулата, наречена PD-1 протеин, който възпрепятства Т-клетките да разпознават и атакуват възпалени тъкани и ракови клетки.
- С блокирането на PD-1 пемпролизумаб увеличава способността на имунната система да атакува меланомни клетки и друг вид висцерални тумори. Лекарството работи, за да отключи Т клетките, така че те да могат да атакуват меланомните клетки в меланома навсякъде в тялото ви.
През 2014 г. Американската агенция по храните и лекарствата (FDA) одобри pembrolizumab за лечение на пациенти с напреднали стадии на меланом:
- Етап III, който е невъзстановим (не може да бъде напълно отстранен чрез хирургична ексцизия)
- Етап IV, известен също като метастазирал (клетки на меланома, които са се разпространили в органите и други части на тялото) т.е.развитие на меланомната болест
Много специалисти препоръчват терапията с анти-PD-1, като пемпролизумаб, като лечение от първа линия за пациенти с напреднал меланом. Пациентите трябва да говорят с лекарите си за рисковете и ползите от различните възможности за лечение като първа линия лечение. Pembrolizumab действа като системно лечение с цел:
- Контролира меланома и свиващите се тумори навсякъде в тялото
- Лечение на симптомите на меланома
- Помогнете на пациентите да живеят по-дълго
Тъй като пемпролизумаб е антитяло, което действа чрез вашата имунна система, то може да предизвика имунологична "памет" в Т клетките. Това означава, че пемпролизумаб може да помогне на имунната система да продължи да атакува клетки на меланома дори след лечение.
Изборът на терапия от страна на лекарят е изкуство, но от друга страна всеки пациент е една вселена и неговият терапевтичен отговор зависи от имунната му система и начин на живот, от подкрепата на близките хора. Поставената диагноза меланом не е статистика за преживяемост, а една промяна в начина на живот и индивидуална терапия за всеки пациент.
Библиография:
-
Zonios G, Dimou A, Bassukas I, Galaris D, Tsolakidis A, Kaxiras E. “ Melanin absorption spectroscopy: new method for noninvasive skin investigation and melanoma detection. “ J Biomed Opt 2008; 13: 014017.
-
Marchesini R, Bono A, Carrara M. “In vivo characterization of melanin in melanocytic lesions: spectroscopic study on 1671 pigmented skin lesions. “ J Biomed Opt 2009; 14: 014027.
-
Sterenborg H, Motamedi M, Wagner RF, Duvic M, Thomsen S, Jacques SL. “ In vivo fluorescence spectroscopy and imaging of human skin tumors “. Lasers Med Sci 1994; 9: 191-201
-
Lohmann W, Nilles M, Boedeker RH.” In situ differentiation between nevi and malignant melanomas by fluorescence measurements”. Naturwissenschaften. 1991; 78:456–457.
-
Sterenborg HJCM, Motamedi M, Wagner RF, Duvic M, Thomsen S, Jacques SL.” In vivo fluorescence spectroscopy and imaging of human skin tumors”. Lasers Med Sci. 1994; 9: 191–201.
-
Marchesini R., Cascinelli N., Brambilla M., Clemente C., Mascheroni L., Pignoli E., Testori A., Venturoli D., „In vivo spectrophotometric evaluation of neoplastic and non-neoplastic skin pigmented lesions. II: Discriminant analysis between nevus and melanoma”, Photochem Photobiol 1992, 55:515-522.
-
Marchesini R., Bono A., Bartoli C., Lualdi M., Tomatis S., Cascinelli N., “Optical imaging and automated melanoma detection: questions and answers“, Melanoma Res 2002; 12:279-286. “
-
Marchesini R., A. Bono, C. Baroli, M. Lualdi, S. Tomatis, N. Cascinelli,” Melanoma Research” (2002), 12, 279 -287.
-
E. Borisova; L. Avramov; P. Pavlova; E. Pavlova; P. Troyanova, “Qualitative optical evaluation of malignancies related to cutaneous phototype”, Proc. SPIE vol. 7563 Dynamics and Fluctuations in Biomedical Photonics VII. 75630X, (2010)
